L’analyse histologique des biopsies confirme la dermatite ulcérative chronique superficielle (DUCS) bactérienne (Fig. 5).
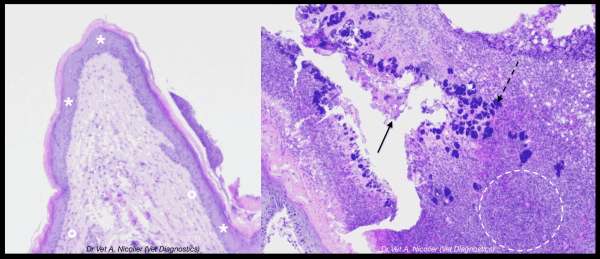
Fig. 4 – L’examen histologique des biopsies cutanées révèle (A) un épiderme hyperplasique (*) et un derme sous-jacent diffusément fibrosé (o). Les zones plus sévèrement affectées (B) présentent de larges zones de nécrose, avec accumulation d’une épaisse couche de fibrine mélangée à de nombreux polynucléaires hétérophiles viables et dégénérés formant des croûtes sérocellulaires (flèche continue). De larges colonies de coques bactériens sont enchâssées dans ces croûtes (flèche tiretée). Le derme montre une perte des annexes et infiltration par des macrophages, polynucléaires hétérophiles et lymphocytes (cercle tireté). Les biopsies en zone saine sont alésionnelles (non illustré). Crédit: Dr A. Nicolier (Vet Diagnostics)
Le traitement des DUCS bactériennes repose sur l’administration d’antidouleurs (méloxicam, tramadol), d’antibiotiques par voie systémique, guidée par une culture et un test de sensibilité, des soins locaux (rinçage avec de la saline stérile et désinfection avec de la chlorhexidine diluée au 1 :40 et sulfadiazine d’argent par exemple), de bandages (de type hydrolloïdes, éventuellement suturés en place pour une meilleure tenue) ainsi que la correction de tout facteur prédisposant éventuel (correction des carences alimentaires, élimination des aérosols et produits tabagiques). Un débridement chirurgical des tissus nécrotiques desséchés peut être nécessaire pour permettre le développement d’un tissu de granulation. Un collier élisabéthain est souvent nécessaire pour limiter l’automutilation et permettre la cicatrisation par seconde intention4. En cas de prurit ou agitation, des antihistaminiques et/ou benzodiazépines peuvent être utilisés à court terme14. La guérison est lente (entre 1 et 21 mois avec une médiane de 2 mois) mais obtenue dans une vaste majorité des cas. Toutefois, environ 18% des oiseaux récidivent ultérieurement de sorte que le pronostic de guérison à long terme demeure réservé4.
N.B. Des cas de S. aureus résistants à la méthicilline (SARM) ont été décrits chez plusieurs Gris du Gabon souffrant de DUCS. Les propriétaires devraient être avisés du risque sanitaire que représentent ces oiseaux15,16.
Remerciements : Dr Alexandra Nicolier, DESV d’Anatomie Pathologique, Dipl. du Collège européen de Pathologie Vétérinaire, Vet Diagnostics, 14 avenue Rockfeller – 69008 Lyon